Тема: Синтез хелатных диаминокарбеновых комплексов платины — потенциальных противораковых препаратов
Закажите новую по вашим требованиям
Представленный материал является образцом учебного исследования, примером структуры и содержания учебного исследования по заявленной теме. Размещён исключительно в информационных и ознакомительных целях.
Workspay.ru оказывает информационные услуги по сбору, обработке и структурированию материалов в соответствии с требованиями заказчика.
Размещение материала не означает публикацию произведения впервые и не предполагает передачу исключительных авторских прав третьим лицам.
Материал не предназначен для дословной сдачи в образовательные организации и требует самостоятельной переработки с соблюдением законодательства Российской Федерации об авторском праве и принципов академической добросовестности.
Авторские права на исходные материалы принадлежат их законным правообладателям. В случае возникновения вопросов, связанных с размещённым материалом, просим направить обращение через форму обратной связи.
📋 Содержание
ГЛАВА 1. ЛИТЕРАТУРНЫЙ ОБЗОР 4
1.1 Биологическая активность диаминокарбеновых комплексов платины 4
1.2 Синтез циклических диаминокарбеновых комплексов платины 14
1.3 Синтез ациклических диаминокарбеновых комплексы платины 17
ГЛАВА 2. ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ 31
2.1 Выбор исходных соединений 31
2.2 Комплексы платины с 3,4-диарил-1Я-пиррол-2,5-дииминами 32
2.3 Комплексы платины с этил 5-амино-3-арил-4-оксо-3,4-дигидротиено[3,4-б]пиридазин-1-карбоксилатами 40
РЕЗУЛЬТАТЫ И ВЫВОДЫ 44
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ 45
БЛАГОДАРНОСТИ 51
СПИСОК ИСПОЛЬЗУЕМОЙ ЛИТЕРАТУРЫ 52
📖 Введение
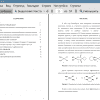
Рисунок 1. Биологически активные комплексы платины.
Другие проявляют недостаточно высокую эффективность, как например трансплатин (4) или комплекс платины с диэтилентриамином (5) (Рисунок 2).
Рисунок 2. Комплексы платины, проявляющие недостаточную активность.
В связи с этим актуален поиск новых, более эффективных и при этом менее токсичных комплексов платины.
✅ Заключение
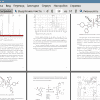
1. Взаимодействие дииодобис(2-метил-6-хлорфенилизоцианид)платины(II) c 3,4-диарил-1Я-пиррол-2,5-дииминами приводит к образованию бисдиаминокарбеновых комплексов платины(IV).
2. Электроноакцепторные заместители в ароматических кольцах нуклеофилов существенно снижают реакционную способность 3,4-диарил-1Н-пиррол-2,5- дииминов в реакциях с бисизонитрильными комплексами Pt(II).
3. Бис(циклогексилизоцианид)дихлороплатина(II) реагирует с аминотиенопиридазинонами в соотношении 1:1 с образованием новых комплексов платины(II).