Тема: Галогенная связь в ассоциатах комплексов платины(II) с йодоформом
Закажите новую по вашим требованиям
Представленный материал является образцом учебного исследования, примером структуры и содержания учебного исследования по заявленной теме. Размещён исключительно в информационных и ознакомительных целях.
Workspay.ru оказывает информационные услуги по сбору, обработке и структурированию материалов в соответствии с требованиями заказчика.
Размещение материала не означает публикацию произведения впервые и не предполагает передачу исключительных авторских прав третьим лицам.
Материал не предназначен для дословной сдачи в образовательные организации и требует самостоятельной переработки с соблюдением законодательства Российской Федерации об авторском праве и принципов академической добросовестности.
Авторские права на исходные материалы принадлежат их законным правообладателям. В случае возникновения вопросов, связанных с размещённым материалом, просим направить обращение через форму обратной связи.
📋 Содержание
Обзор литературы ........................................................................................................... 5
Диалкилцианамидные комплексы переходных металлов ......................................... 5
Комплексы платины(II) как акцепторы галогенных связей .................................... 13
Иодоформ как донор галогенных связей ................................................................... 25
Изоструктурная замена Cl/Br ...................................................................................... 28
Цель и задачи ВКР ........................................................................................................ 34
Экспериментальная часть ........................................................................................... 35
Приборы и материалы ................................................................................................ 35
Синтез комплексов транс-[PtBr2(NCNCR2)2] ............................................................ 36
Кристаллизация транс-[PtBr2(NCNCR2 )2 ]с иодоформом ......................................... 39
Обсуждение результатов .............................................................................................. 40
Описание ассоциатов с иодоформом ......................................................................... 40
Описание слабых взаимодействий ............................................................................. 46
Результаты теоретических расчётов .......................................................................... 54
Изоструктурная замена ................................................................................................ 60
Выводы ............................................................................................................................ 63
Список сокращений и условных обозначений ........................................................ 64
Список литературы ....................................................................................................... 65
📖 Введение
в последнее время уделяется всё большее внимание научного сообщества [1].
Наряду с другими типами слабых взаимодействий, явление образования
галогенных связей активно используется для инженерии кристаллов и построении
супрамолекулярных структур [1,2]. Причём возможна структуризация как
металлорганических ассоциатов (образование наночастиц в растворе за счёт
слипания молекул), так и полимерных молекул (упорядоченная кристаллизация за
счёт образования коротких контактов) [2]. Галогенные связи в целом ряде случаев
определяют функционирование биологических систем [1,3]. Среди последних
практических приложений явления галогенных связей – стабилизация взрывчатых
веществ за счёт осуществления сокристаллизации двух нестабильных соединений с
образованием устойчивого аддукта [4] и создание систем с регулируемыми
фотофизическими свойствами [5].
Согласно определению ИЮПАК [6], галогенная связь существует, когда
есть доказательство притяжения между электрофильной областью на атоме
галогена в составе одного молекулярного фрагмента и нуклеофильной
областью другого или того же самого молекулярного фрагмента. На первый
взгляд, сам факт наличия на атоме галогена «электрофильной области» кажется
противоречащим здравому смыслу – ведь в большинстве своих соединений атомы
галогена связаны с менее электроотрицательными атомами [1]. Тем не менее, в
литературе было показано, что распределение электронной плотности
относительно ковалентно связанных атомов галогенов анизотропно, и напротив
связи R–X (X = Cl, Br, I) имеется область с положительным электростатическим
потенциалом (так называемая -дырка) [7,8]. Эта область соответствует *-
разрыхляющей орбитали связи R–X [1]. Именно с -дыркой с электростатической
точки зрения и с *-разрыхляющей орбиталью с орбитальной точки зрения
возможно взаимодействие различных нуклеофильных центров с ковалентно
связанным атомом галогена. Отсюда возникает геометрическое требование к
галогенной связи – фрагмент R–X···D (D – нуклеофильный центр) должен быть
линейным, и угол R–X···D должен быть близок к 180°. Согласно ИЮПАК [6],
принят и второй геометрический критерий – расстояние X···D должно быть
меньше соответствующих ван-дер-ваальсовых радиусов – в таком случае
взаимодействие отличается от дисперсионного.
В большинстве работ по галогенным связям в качестве нуклеофильного
центра (или акцептора галогенной связи) выступают органические вещества –
посредством своих π-систем и содержащих минимум по одной неподелённой паре
гетероатомов. Большое количество работ также посвящено галогенным связям с
галогенидными лигандами в качестве оснований Льюиса [1].
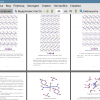
Рисунок 1. Типичная геометрия галогенной связи R–X···X–M.
В последнее время всё большее внимание уделяется изучению галогенных
связей с участием галогенидных комплексов переходных металлов [9]. Так как
даже для галогенидных лигандов характерно анизотропное распределение
электронной плотности, наиболее отрицательно заряженной областью
координированного галогенида будет тор, перпендикулярный связи X–M (M – атом
металла). Таким образом, с учётом этой особенности, для галогенной связи R–
X···X–M существует три критерия: расстояние X···X меньше суммы ван-дер-
ваальсовых радиусов, угол R–X···X близок к 180°, а угол X···X–M близок к 90°
(Рис. 1). Последние исследования в области распределения потенциала вокруг
координированного иода показывают, что несмотря на анизотропность этого
распределения по поверхности атома, знак потенциала со всех сторон отрицателен,
то есть, σ-дырка существует лишь номинально, и большие отклонения от второго
углового критерия вполне возможны как для атома иода в качестве акцептора
галогенной связи, так и для других, менее поляризуемых галогенов.
✅ Заключение
образования галогенных связей с металлом в ассоциатах комплекса
[PtBr2(NCNMe2)2] с иодоформом 1•2CHI3-α и 1•2CHI3-β. При переходе от
известных аддуктов [PtCl2(NCNMe2)2]•2CHI3 и [PtCl2(NCNEt2)2]•2CHI3 к 1•2CHI 3 -α
и 2•2CHI3 была реализована изоструктурная замена хлор-бром. Установлено, что
выбор растворителя оказывает влияние на кристаллизацию [PtBr2(NCNMe2)2] с
иодоформом. Во всех аддуктах зафиксированы галогенные связи с бромидом, а
также в 1•2CHI 3 -β и 3•0.42CHCl3•1.58CHI3 – водородные связи с бромидом.