Сравнение методов анальгезии после видеоторакоскопических лобэктомий
|
Введение 4
Глава 1. Применение регионарных и системных методов анальгезии у пациентов перенесших ВТС оперативные вмешательства 9
1.1 Паравертебральная блокада грудного отдела позвоночного столба 9
1.2 Межреберная блокада 13
1.3 Системные анальгетические препараты 14
1.4 Сравнение методов регионарной и системной анальгезии 16
Глава 2. Материал и методы 19
2.1 Методика проведения обезболивания 19
2.2 Характеристика больных 21
2.3 Анализируемые параметры 23
2.4 Статистический анализ 26
Глава 3. Результаты обезболивания пациентов в зависимости от метода послеоперационной анальгезии 27
Заключение 41
Выводы 45
Список литературы 46
Глава 1. Применение регионарных и системных методов анальгезии у пациентов перенесших ВТС оперативные вмешательства 9
1.1 Паравертебральная блокада грудного отдела позвоночного столба 9
1.2 Межреберная блокада 13
1.3 Системные анальгетические препараты 14
1.4 Сравнение методов регионарной и системной анальгезии 16
Глава 2. Материал и методы 19
2.1 Методика проведения обезболивания 19
2.2 Характеристика больных 21
2.3 Анализируемые параметры 23
2.4 Статистический анализ 26
Глава 3. Результаты обезболивания пациентов в зависимости от метода послеоперационной анальгезии 27
Заключение 41
Выводы 45
Список литературы 46
Рак легкого является одним из самых распространенных онкологических заболеваний во всем мире. Тысячи пациентов ежегодно подвергаются хирургическому лечению рака легкого. Эффективное обезболивание после торакальных операций остается актуальной темой [1].
Возникновение послеоперационной боли опосредовано ноцицептивными соматическими и висцеральными, невропатическими механизмами, а также отраженной болью от диафрагмального нерва. Разрез кожи, введение троакара, расщепление мышц, ретракция ребер, повреждение грудной стенки и плевры, а также постановка дренажей способствуют раздражению соматических афферентных ноцицепторов и активации межреберных нервов. Сигнал передается от межреберных нервов к ипсилатеральным дорсальным рогам спинного мозга, затем к контрлатеральным переднебоковым канатикам, посредством которых болевой импульс поднимается к лимбической системе и соматосенсорной коре [2,3].
Медиаторы воспаления, включая простагландины, брадикинин, гистамин и калий, высвобождаются из места повреждения и непосредственно активируют ноцицептивные рецепторы. Если эта активация продолжается, возникает повышенная возбудимость нейронов дорсальных рогов спинного мозга, что приводит к высвобождению глутамата, который активирует рецепторы N-метил-В-аспартата (NMDA). Активация рецепторов NMDA заставляет нейроны спинного мозга становиться более восприимчивыми к его входным сигналам, увеличивает реакцию клетки на болезненные стимулы, снижает чувствительность нейронов к агонистам опиоидных рецепторов [4,5].
Висцеральная болевая чувствительность возникает из блуждающего нерва, поскольку он получает ноцицептивные импульсы от легких, средостения и медиастинальной плевры, в то время как диафрагмальный нерв получает импульсы от диафрагмальной плевры [3, 5, 6].
Невропатическая боль возникает в результате прямого повреждения межреберных нервов и приводит к гиперчувствительности и невралгии, включая дизестезию, аллодинию, гипералгезию и гиперпатию [4].
Кроме того, острая послеоперационная боль способствует нарушению биомеханики внешнего дыхания, усилению стрессовой реакции с изменением гормонального и иммунного ответа, а также может привести к респираторным осложнениям, таким как гиповентиляция, затруднения откашливания, ателектаз, пневмония оперированного легкого, гипоксемия, и, в конечном итоге, к декомпенсации дыхательной недостаточности. Послеоперационная боль снижает качество жизни пациентов, может увеличивать срок госпитализации и способствовать формированию хронического болевого синдрома [7].
Несмотря на современные исследования в области патофизиологии и фармакологии ноцицепции, послеоперационный болевой синдром продолжает оставаться сложной задачей для практикующих врачей - анестезиологов и хирургов.
Согласно рекомендациям ERAS, после хирургического лечения заболеваний легких необходима комплексная терапия, важной составляющей которой является мультимодальное обезболивание [8]. Данный подход предусматривает использование двух и более анальгетиков, обладающих различными механизмами действия и позволяющих достичь адекватного обезболивания при минимуме побочных эффектов. Эффективной стратегией обезболивания, позволяющей снизить риски возникновения послеоперационного болевого синдрома, является применение системных анальгетиков в сочетании с регионарными методами анальгезии [9, 10].
В настоящее время «золотым» стандартом обезболивания после операций, выполненных из торакотомного доступа, является эпидуральная анестезия (ЭА) в сочетании с системным введением анальгетиков. Данный метод обладает высоким качеством обезболивания, однако имеет ряд возможных осложнений, таких как выраженное снижение артериального давления, задержка мочи, риск пункции твердой мозговой оболочки, развития ее инфекционных поражений, а также ограничение применения при гипокоагуляции и тромбоцитопении [11, 12].
Кроме того, в последние годы в хирургической практике широко стали применяться малоинвазивные методы лечения. В настоящее время около 70% радикальных операций при раке легкого выполняется из видеоторакоскопического доступа (ВТС) [13]. После таких вмешательств восстановление пациентов протекает быстрее, с меньшим количеством осложнений, что сокращает время пребывания в стационаре. Менее травматичный доступ значительно снижает интенсивность болевого синдрома в послеоперационном периоде [14]. Невысокая травматичность подобных вмешательств вызвала дискуссию о целесообразности применения у данной категории пациентов эпидуральной анальгезии.
Применение ЭА при операциях, выполненных из ВТС доступа, считается избыточным ввиду сопоставимых результатов обезболивания в сравнении с другими регионарными методами и методами системной анальгезии, а также большего количества нежелательных побочных эффектов и осложнений. Так, например, в ретроспективном анализе 2019 года был проведен сравнительный анализ выраженности болевого синдрома у пациентов в послеоперационном периоде по визуально-аналоговой шкале (ВАШ) между группами пациентов с паравертебральной блокадой (ПВБ), эпидуральной анальгезией и контрольной группой без регионарных методик с применением наркотических и ненаркотических анальгетиков. Во всех трех группах в периоперационном периоде обеспечивалась эффективная анальгезия (ВАШ<4) [15].
На сегодняшний день в литературе обсуждается вопрос эффективности продленной паравертебральной регионарной анальгезии в сравнени с межреберной блокадой (МБ) при видеоторакоскопических оперативных вмешательствах, а также метода системного обезболивания таких пациентов путем парентерального введения опиоидных и неопиоидных анальгетиков [16, 60].
Некоторые авторы утверждают, что применение продленной ПВБ у пациентов после ВТС лобэктомий достоверно снижает послеоперационный болевой синдром (ВАШ во всех точках p<0.05), количество послеоперационных осложнений и длительность послеоперационного койкодня (4,6±1,0 против 6,1±1,3) в сравнении с системным методом обезболивания [17]. Другие исследователи отмечают преимущество межреберной блокады над системным обезболиванием [18]. В то же время, J. Jung и соавторы считают применение регионарных методов обезболивания эквивалентным системному [19].
Таким образом, необходимость применения регионарных методов обезболивания после видеоторакоскопических операций остается предметом дискуссий и оптимальный подход к послеоперационному обезболиванию окончательно не определен.
Цель исследования
Разработать оптимальную схему обезболивания у пациентов после видеоторакоскопических расширенных лобэктомий, выполненных по поводу новообразований легких.
Задачи исследования:
1. Провести сравнительный анализ эффективности трех видов мультимодального обезболивания после видеоторакоскопических лобэктомий: продленной паравертебральной или межреберной блокады в комбинации с парентеральным введением анальгетиков, а также парентерального обезболивания сочетанием наркотических и ненаркотических анальгетиков.
2. Сравнить потребность в наркотических и ненаркотических анальгетиках в исследуемых группах.
3. Оценить влияние метода обезболивания на функцию внешнего дыхания, уровень стрессовых гормонов в смешанной венозной крови и основные параметры газообмена у больных в раннем послеоперационном периоде.
4. Проанализировать безопасность применения методов регионарного обезболивания у пациентов после видеоторакоскопических расширенных лобэктомий по поводу рака легкого, сопоставить частоту, характер послеоперационных осложнений (гиповентиляция, ателектаз, пневмония оперированного легкого) и сроки госпитализации в исследуемых группах.
Возникновение послеоперационной боли опосредовано ноцицептивными соматическими и висцеральными, невропатическими механизмами, а также отраженной болью от диафрагмального нерва. Разрез кожи, введение троакара, расщепление мышц, ретракция ребер, повреждение грудной стенки и плевры, а также постановка дренажей способствуют раздражению соматических афферентных ноцицепторов и активации межреберных нервов. Сигнал передается от межреберных нервов к ипсилатеральным дорсальным рогам спинного мозга, затем к контрлатеральным переднебоковым канатикам, посредством которых болевой импульс поднимается к лимбической системе и соматосенсорной коре [2,3].
Медиаторы воспаления, включая простагландины, брадикинин, гистамин и калий, высвобождаются из места повреждения и непосредственно активируют ноцицептивные рецепторы. Если эта активация продолжается, возникает повышенная возбудимость нейронов дорсальных рогов спинного мозга, что приводит к высвобождению глутамата, который активирует рецепторы N-метил-В-аспартата (NMDA). Активация рецепторов NMDA заставляет нейроны спинного мозга становиться более восприимчивыми к его входным сигналам, увеличивает реакцию клетки на болезненные стимулы, снижает чувствительность нейронов к агонистам опиоидных рецепторов [4,5].
Висцеральная болевая чувствительность возникает из блуждающего нерва, поскольку он получает ноцицептивные импульсы от легких, средостения и медиастинальной плевры, в то время как диафрагмальный нерв получает импульсы от диафрагмальной плевры [3, 5, 6].
Невропатическая боль возникает в результате прямого повреждения межреберных нервов и приводит к гиперчувствительности и невралгии, включая дизестезию, аллодинию, гипералгезию и гиперпатию [4].
Кроме того, острая послеоперационная боль способствует нарушению биомеханики внешнего дыхания, усилению стрессовой реакции с изменением гормонального и иммунного ответа, а также может привести к респираторным осложнениям, таким как гиповентиляция, затруднения откашливания, ателектаз, пневмония оперированного легкого, гипоксемия, и, в конечном итоге, к декомпенсации дыхательной недостаточности. Послеоперационная боль снижает качество жизни пациентов, может увеличивать срок госпитализации и способствовать формированию хронического болевого синдрома [7].
Несмотря на современные исследования в области патофизиологии и фармакологии ноцицепции, послеоперационный болевой синдром продолжает оставаться сложной задачей для практикующих врачей - анестезиологов и хирургов.
Согласно рекомендациям ERAS, после хирургического лечения заболеваний легких необходима комплексная терапия, важной составляющей которой является мультимодальное обезболивание [8]. Данный подход предусматривает использование двух и более анальгетиков, обладающих различными механизмами действия и позволяющих достичь адекватного обезболивания при минимуме побочных эффектов. Эффективной стратегией обезболивания, позволяющей снизить риски возникновения послеоперационного болевого синдрома, является применение системных анальгетиков в сочетании с регионарными методами анальгезии [9, 10].
В настоящее время «золотым» стандартом обезболивания после операций, выполненных из торакотомного доступа, является эпидуральная анестезия (ЭА) в сочетании с системным введением анальгетиков. Данный метод обладает высоким качеством обезболивания, однако имеет ряд возможных осложнений, таких как выраженное снижение артериального давления, задержка мочи, риск пункции твердой мозговой оболочки, развития ее инфекционных поражений, а также ограничение применения при гипокоагуляции и тромбоцитопении [11, 12].
Кроме того, в последние годы в хирургической практике широко стали применяться малоинвазивные методы лечения. В настоящее время около 70% радикальных операций при раке легкого выполняется из видеоторакоскопического доступа (ВТС) [13]. После таких вмешательств восстановление пациентов протекает быстрее, с меньшим количеством осложнений, что сокращает время пребывания в стационаре. Менее травматичный доступ значительно снижает интенсивность болевого синдрома в послеоперационном периоде [14]. Невысокая травматичность подобных вмешательств вызвала дискуссию о целесообразности применения у данной категории пациентов эпидуральной анальгезии.
Применение ЭА при операциях, выполненных из ВТС доступа, считается избыточным ввиду сопоставимых результатов обезболивания в сравнении с другими регионарными методами и методами системной анальгезии, а также большего количества нежелательных побочных эффектов и осложнений. Так, например, в ретроспективном анализе 2019 года был проведен сравнительный анализ выраженности болевого синдрома у пациентов в послеоперационном периоде по визуально-аналоговой шкале (ВАШ) между группами пациентов с паравертебральной блокадой (ПВБ), эпидуральной анальгезией и контрольной группой без регионарных методик с применением наркотических и ненаркотических анальгетиков. Во всех трех группах в периоперационном периоде обеспечивалась эффективная анальгезия (ВАШ<4) [15].
На сегодняшний день в литературе обсуждается вопрос эффективности продленной паравертебральной регионарной анальгезии в сравнени с межреберной блокадой (МБ) при видеоторакоскопических оперативных вмешательствах, а также метода системного обезболивания таких пациентов путем парентерального введения опиоидных и неопиоидных анальгетиков [16, 60].
Некоторые авторы утверждают, что применение продленной ПВБ у пациентов после ВТС лобэктомий достоверно снижает послеоперационный болевой синдром (ВАШ во всех точках p<0.05), количество послеоперационных осложнений и длительность послеоперационного койкодня (4,6±1,0 против 6,1±1,3) в сравнении с системным методом обезболивания [17]. Другие исследователи отмечают преимущество межреберной блокады над системным обезболиванием [18]. В то же время, J. Jung и соавторы считают применение регионарных методов обезболивания эквивалентным системному [19].
Таким образом, необходимость применения регионарных методов обезболивания после видеоторакоскопических операций остается предметом дискуссий и оптимальный подход к послеоперационному обезболиванию окончательно не определен.
Цель исследования
Разработать оптимальную схему обезболивания у пациентов после видеоторакоскопических расширенных лобэктомий, выполненных по поводу новообразований легких.
Задачи исследования:
1. Провести сравнительный анализ эффективности трех видов мультимодального обезболивания после видеоторакоскопических лобэктомий: продленной паравертебральной или межреберной блокады в комбинации с парентеральным введением анальгетиков, а также парентерального обезболивания сочетанием наркотических и ненаркотических анальгетиков.
2. Сравнить потребность в наркотических и ненаркотических анальгетиках в исследуемых группах.
3. Оценить влияние метода обезболивания на функцию внешнего дыхания, уровень стрессовых гормонов в смешанной венозной крови и основные параметры газообмена у больных в раннем послеоперационном периоде.
4. Проанализировать безопасность применения методов регионарного обезболивания у пациентов после видеоторакоскопических расширенных лобэктомий по поводу рака легкого, сопоставить частоту, характер послеоперационных осложнений (гиповентиляция, ателектаз, пневмония оперированного легкого) и сроки госпитализации в исследуемых группах.
Многие торакальные операции, которые раньше выполнялись из широкого доступа - торакотомии, теперь могут выполняться из нескольких небольших разрезов с применением видеоторакоскопии. Одним из преимуществ ВТС по сравнению с открытой операцией является уменьшение послеоперационной боли. Тем не менее, видеоторакоскопическая лобэктомия по-прежнему ассоциируется с выраженным послеоперационным болевым синдромом [40]. А с ростом числа выполняемых видеоторакоскопических вмешательств, растет спрос на научно-обоснованный подход к обезболиванию при ВТС [52].
На сегодняшний день в литературе наиболее активно обсуждается вопрос необходимости применения регионарной анальгезии при видеоторакоскопических оперативных вмешательствах. Оптимальный метод обезболивания у таких пациентов до конца не определен [15].
В настоящем исследовании проанализированы результаты обследования и лечения больных после анатомической резекции легкого с лимфодиссекцией по поводу немелкоклеточного рака легкого (НМРЛ) в зависимости от метода обезболивания. Научная новизна и практическая значимость данного исследования заключается в комплексном сравнении трех различных методик обезболивания пациентов после видеоторакоскопических операций, при отсутствии единого стандарта обезболивания.
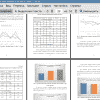
Первичной конечной точкой исследования является определение интенсивности болевого синдрома по визуально-аналоговой шкале боли в покое и при кашле. В исследовании уровень ВАШ у пациентов после проведения продленной паравертебральной блокады достоверно ниже, чем у пациентов, которым не применяли регионарные методы анальгезии в 22:00 на первые сутки после операции в покое (p=0,021) и в 23:00 на третьи сутки после операции в покое и при кашле (p<0,05). Наши данные соотносятся с данными литературы, так, авторы одного исследования продемонстрировали более низкие значения ВАШ в покое и при кашле в группе ПВБ в сравнении с группой системной анальгезии за все время наблюдения (p<0,05) [17].
Уровень ВАШ у пациентов в покое после выполнения межреберной блокады также был достоверно ниже, чем в группе больных без проведения регионарных методик (p=0,039) в 22:00 в первые сутки после операции и в 23:00 при кашле в 3 сутки после операции (p=0,009). Аналогично этим данным, Zulficar A. отметил, что обезболивание пациентов после применения МБ достоверно лучше в первые 6 часов после операции [18].
При сравнении графических моделей уровня ВАШ в покое и при кашле, была продемонстрирована тенденция к более низким значениям уровня боли по ВАШ в группе паравертебральной блокады, напротив, в группе системной анальгезии отмечается тенденция к более высоким значениям. Межреберная блокада занимала промежуточное положение между сравниваемыми методами.
В настоящее время остро стоит вопрос целесообразности длительного применения наркотических анальгетиков в послеоперационном периоде, кроме того, особенно важно сосредоточить внимание на возможностях сокращения использования опиоидов [53, 54]. Многие авторы в своих исследованиях отметили, что применение регионарных методов анальгезии, значительно уменьшает потребление анальгетиков [18, 44]. В данном исследовании была отмечена тенденция к более низкому расходу наркотических анальгетиков и НПВС в группе паравертебральной блокады, тогда как в группе системной анальгезии было потрачено большее количество обезболивающих препаратов.
Выраженный послеоперационный болевой синдром способствует нарушению дыхательной экскурсии грудной клетки, уменьшению глубины вдоха, ухудшению вентиляции легких, что в свою очередь может приводить к изменению нормального газового состава крови. Болевой синдром не позволяет пациенту эффективно реализовать кашлевой рефлекс, затрудняет экспекторацию мокроты, вызывает перенапряжение вспомогательной дыхательной мускулатуры и увеличивает натяжение швов на послеоперационной ране, что приводит к усилению боли. При анализе показателей газового состава крови (pH, PaO2, PaCO2, индекса оксигенации Horovitz) были выявлены статистически значимые различия между группами на 3 сутки после операции по параметрам PaO2 (p=0,018 ) и респираторного индекса (p=0,002). В группе межреберной блокады на третьи сутки после операции PaO2 и респираторный индекс были достоверно ниже, чем в группе паравертебральной блокады и в группе системной анальгезии. Достоверных различий по параметрам функции внешнего дыхания, получено не было.
Параметры высоты стояния диафрагмы и времени удаления дренажа напрямую связаны с нормализацией легочной функции пациентов, которая возможна только в условиях адекватного обезболивания. Уровень высоты стояния диафрагмы был ниже в группе паравертебральной блокады, а время удаления дренажа меньше в сравнении с остальными группами.
В исследовании все выявленные осложнения по Clavien - Dindo относились либо к 1 степени и не требовали медикаментозного и хирургического вмешательства, либо ко 2 степени - тогда назначались минимально эффективные дозы медикаментозных препаратов, в результате чего выявленные осложнения были успешно купированы. Другие исследователи в своих работах выявили более высокое количество послеоперационных осложнений в группе системной анальгезии, к тому же среди послеоперационных осложнений были выявлены такие как эмпиема плевры, повторная операция, пневмония [44].
Послеоперационная гипертензия обычно развивается через 20 минут после хирургического вмешательства и продолжается до 4 часов и более. Симпатическая стимуляция как ответ на острую боль, индуцирует вазоконстрикцию и стимулирует рост АД [55]. В одной из работ авторы выявили повышенную частоту развития гипертензии среди пациентов в группе системной анальгезии [15]. В данном исследовании гемодинамика в послеоперационном периоде была стабильна у всех пациентов. Артериальное давление оставалось в пределах физиологической нормы во всех трёх группах.
Боль, в свою очередь, как проявление операционного стресса может приводить к повышению в крови уровня гормонов стресса [56, 57]. Достоверных различий в уровнях гормонов стресса до и после операции получено не было.
Время пребывания в стационаре отражает общее течение послеоперационного периода. Было определено, что в группе паравертебральной блокады послеоперационный койко-день был существенно ниже, чем в остальных группах.
Таким образом, применение продленного паравертебрального блока является безопасным и эффективным методом обезболивания пациентов после видеоторакоскопических лобэктомий, достоверно уменьшает интенсивность болевого синдрома в послеоперационном периоде в сравнении с межреберным блоком и системным обезболиванием без применения регионарных методик.
На сегодняшний день в литературе наиболее активно обсуждается вопрос необходимости применения регионарной анальгезии при видеоторакоскопических оперативных вмешательствах. Оптимальный метод обезболивания у таких пациентов до конца не определен [15].
В настоящем исследовании проанализированы результаты обследования и лечения больных после анатомической резекции легкого с лимфодиссекцией по поводу немелкоклеточного рака легкого (НМРЛ) в зависимости от метода обезболивания. Научная новизна и практическая значимость данного исследования заключается в комплексном сравнении трех различных методик обезболивания пациентов после видеоторакоскопических операций, при отсутствии единого стандарта обезболивания.
Первичной конечной точкой исследования является определение интенсивности болевого синдрома по визуально-аналоговой шкале боли в покое и при кашле. В исследовании уровень ВАШ у пациентов после проведения продленной паравертебральной блокады достоверно ниже, чем у пациентов, которым не применяли регионарные методы анальгезии в 22:00 на первые сутки после операции в покое (p=0,021) и в 23:00 на третьи сутки после операции в покое и при кашле (p<0,05). Наши данные соотносятся с данными литературы, так, авторы одного исследования продемонстрировали более низкие значения ВАШ в покое и при кашле в группе ПВБ в сравнении с группой системной анальгезии за все время наблюдения (p<0,05) [17].
Уровень ВАШ у пациентов в покое после выполнения межреберной блокады также был достоверно ниже, чем в группе больных без проведения регионарных методик (p=0,039) в 22:00 в первые сутки после операции и в 23:00 при кашле в 3 сутки после операции (p=0,009). Аналогично этим данным, Zulficar A. отметил, что обезболивание пациентов после применения МБ достоверно лучше в первые 6 часов после операции [18].
При сравнении графических моделей уровня ВАШ в покое и при кашле, была продемонстрирована тенденция к более низким значениям уровня боли по ВАШ в группе паравертебральной блокады, напротив, в группе системной анальгезии отмечается тенденция к более высоким значениям. Межреберная блокада занимала промежуточное положение между сравниваемыми методами.
В настоящее время остро стоит вопрос целесообразности длительного применения наркотических анальгетиков в послеоперационном периоде, кроме того, особенно важно сосредоточить внимание на возможностях сокращения использования опиоидов [53, 54]. Многие авторы в своих исследованиях отметили, что применение регионарных методов анальгезии, значительно уменьшает потребление анальгетиков [18, 44]. В данном исследовании была отмечена тенденция к более низкому расходу наркотических анальгетиков и НПВС в группе паравертебральной блокады, тогда как в группе системной анальгезии было потрачено большее количество обезболивающих препаратов.
Выраженный послеоперационный болевой синдром способствует нарушению дыхательной экскурсии грудной клетки, уменьшению глубины вдоха, ухудшению вентиляции легких, что в свою очередь может приводить к изменению нормального газового состава крови. Болевой синдром не позволяет пациенту эффективно реализовать кашлевой рефлекс, затрудняет экспекторацию мокроты, вызывает перенапряжение вспомогательной дыхательной мускулатуры и увеличивает натяжение швов на послеоперационной ране, что приводит к усилению боли. При анализе показателей газового состава крови (pH, PaO2, PaCO2, индекса оксигенации Horovitz) были выявлены статистически значимые различия между группами на 3 сутки после операции по параметрам PaO2 (p=0,018 ) и респираторного индекса (p=0,002). В группе межреберной блокады на третьи сутки после операции PaO2 и респираторный индекс были достоверно ниже, чем в группе паравертебральной блокады и в группе системной анальгезии. Достоверных различий по параметрам функции внешнего дыхания, получено не было.
Параметры высоты стояния диафрагмы и времени удаления дренажа напрямую связаны с нормализацией легочной функции пациентов, которая возможна только в условиях адекватного обезболивания. Уровень высоты стояния диафрагмы был ниже в группе паравертебральной блокады, а время удаления дренажа меньше в сравнении с остальными группами.
В исследовании все выявленные осложнения по Clavien - Dindo относились либо к 1 степени и не требовали медикаментозного и хирургического вмешательства, либо ко 2 степени - тогда назначались минимально эффективные дозы медикаментозных препаратов, в результате чего выявленные осложнения были успешно купированы. Другие исследователи в своих работах выявили более высокое количество послеоперационных осложнений в группе системной анальгезии, к тому же среди послеоперационных осложнений были выявлены такие как эмпиема плевры, повторная операция, пневмония [44].
Послеоперационная гипертензия обычно развивается через 20 минут после хирургического вмешательства и продолжается до 4 часов и более. Симпатическая стимуляция как ответ на острую боль, индуцирует вазоконстрикцию и стимулирует рост АД [55]. В одной из работ авторы выявили повышенную частоту развития гипертензии среди пациентов в группе системной анальгезии [15]. В данном исследовании гемодинамика в послеоперационном периоде была стабильна у всех пациентов. Артериальное давление оставалось в пределах физиологической нормы во всех трёх группах.
Боль, в свою очередь, как проявление операционного стресса может приводить к повышению в крови уровня гормонов стресса [56, 57]. Достоверных различий в уровнях гормонов стресса до и после операции получено не было.
Время пребывания в стационаре отражает общее течение послеоперационного периода. Было определено, что в группе паравертебральной блокады послеоперационный койко-день был существенно ниже, чем в остальных группах.
Таким образом, применение продленного паравертебрального блока является безопасным и эффективным методом обезболивания пациентов после видеоторакоскопических лобэктомий, достоверно уменьшает интенсивность болевого синдрома в послеоперационном периоде в сравнении с межреберным блоком и системным обезболиванием без применения регионарных методик.