Тема: Влияние двухсосудистой ишемии головного мозга на систему антиоксидантной защиты и выживаемость нейронов в коре мозга стареющих самцов крыс Wistar
Закажите новую по вашим требованиям
Представленный материал является образцом учебного исследования, примером структуры и содержания учебного исследования по заявленной теме. Размещён исключительно в информационных и ознакомительных целях.
Workspay.ru оказывает информационные услуги по сбору, обработке и структурированию материалов в соответствии с требованиями заказчика.
Размещение материала не означает публикацию произведения впервые и не предполагает передачу исключительных авторских прав третьим лицам.
Материал не предназначен для дословной сдачи в образовательные организации и требует самостоятельной переработки с соблюдением законодательства Российской Федерации об авторском праве и принципов академической добросовестности.
Авторские права на исходные материалы принадлежат их законным правообладателям. В случае возникновения вопросов, связанных с размещённым материалом, просим направить обращение через форму обратной связи.
📋 Содержание
ВВЕДЕНИЕ 5
ГЛАВА 1. ОБЗОР ЛИТЕРАТУРЫ 9
1.1. Старение и морфологические особенности стареющего мозга 9
1.2. Окислительный стресс в качестве основного элемента старения клетки 11
1.3. Патогенез ишемического повреждения головного мозга 13
1.4. Ферментативные и неферментативные антиоксидантные системы 16
1.5. Связь между окислительным стрессом и запуском апоптоза 17
1.6. Ишемия-реперфузия в мозге молодых животных 19
1.7. Ишемия-реперфузия в мозге стареющих животных 20
ГЛАВА 2. МАТЕРИАЛЫ И МЕТОДЫ 22
2.1. Экспериментальная модель глобальной двухсосудистой ишемии переднего мозга крыс с гипотензией и реперфузией 22
2.2. Количественная полимеразная цепная реакция в реальном времени, совмещенная с обратной транскрипцией 23
2.2.1. Выделение тотальной РНК 23
2.2.2. Обратная транскрипция, совмещенная с полимеразной цепной реакцией 24
2.2.3. Количественная полимеразная цепная реакция с детекцией в реальном времени 24
2.2.4. Анализ данных полимеразной цепной реакции с детекцией в реальном времени 25
2.3. Изучение уровня продуктов перекисного окисления липидов 25
2.3.1. Выделение липидов из тканей головного мозга 25
2.3.2. Метод количественного определения диеновых и триеновых конъюгатов 26
2.3.3. Метод количественного определения оснований Шиффа 27
2.3.4. Метод определения содержания продуктов, реагирующих с тиобарбитуровой кислотой 27
2.4. Определение активности На+,К+-АТФазы 28
2.5. Статистическая обработка данных 28
ГЛАВА 3. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ОБСУЖДЕНИЕ 29
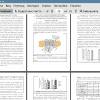
3.1. Изучение влияния ишемии и реперфузии различной длительности на активность Иа+,К+-АТФазы и экспрессию ее субъединиц в коре головного мозга старых крыс 29
3.2. Изучение влияния ишемии и реперфузии различной продолжительности на накопление продуктов перекисного окисления липидов в коре головного мозга старых крыс 32
3.3. Изучение влияния ишемии и реперфузии различной длительности на интенсивность апоптотических процессов в мозге стареющих крыс 33
3.4. Изучение экспрессии генов, кодирующих белки антиоксидантной системы, в условиях ишемии и реперфузии различной продолжительности в мозге стареющих крыс 35
3.5. Исследование изменения экспрессии гена нейрональной NO-синтазы в ответ на ишемию-реперфузию в стареющем мозге 37
ЗАКЛЮЧЕНИЕ 39
ВЫВОДЫ 40
БЛАГОДАРНОСТИ 41
СПИСОК ЛИТЕРАТУРЫ 42
ПРИЛОЖЕНИЕ 52
📖 Введение
Наибольшая заболеваемость ишемическим инсультом приходится на группу лиц старшего возраста (55+ лет), и каждые последующие десять лет жизни риск инсульта увеличивается вдвое [6]. В сочетании с общемировой тенденцией к увеличению ожидаемой продолжительности жизни [7], можно заключить, что распространенность данной патологии, как и смертность от нее, будет только расти.
Ишемический инсульт возникает в результате нарушения притока крови к веществу головного мозга, наиболее часто - вследствие тромбоза мозговых артерий. Сосудистая патология приводит к развитию биохимических реакций, включающих деструкцию активными формами кислорода (АФК) молекул белков, нуклеиновых кислот и липидов. Неконтролируемое свободнорадикальное окисление становится причиной истощения эндогенных антиоксидантных систем и нарушению внутриклеточной регуляции [8]. Следствием вышеуказанных патологических процессов становится гибель нейронов путем некроза, апоптоза или аутофагии [9]. Тяжесть повреждения, в первую очередь, зависит от длительности ишемического воздействия, а также от возраста пациента и предшествующего функционального состояния организма [10].
Восстановление кровотока - медикаментозное или спонтанное - запускает процесс реперфузии. Несмотря на закономерное предположение о положительном влиянии ранней реперфузии, уже в 1970-е годы оно было поставлено под сомнение сообщениями о парадоксальном усилении повреждения при восстановлении кровотока [11]. Реперфузия и сопровождающая ее реоксигенация индуцирует вторую, более мощную волну генерации АФК [12-14], и это явление называют «реперфузионным повреждением». В настоящее время это одна из наиболее активно развивающихся областей медицины. Реперфузионное повреждение создает дополнительную проблему для изучения последствий лечения ишемических заболеваний и профилактики их осложнений.
В связи с этим, одним из наиболее актуальных направлений в экспериментальной медицине является изучение патогенеза ишемического повреждения нейронов и поиск эффективных нейропротекторов для его предупреждения и лечения. Успех доклинических испытаний потенциальных нейропротекторов и возможность применения результатов этих испытаний в клинической практике во многом зависит от выбранной модели заболевания. Большинство исследований проводится на животных молодого и среднего возраста (3-10 месяцев). Однако подобный выбор возраста противоречит эпидемиологии заболевания, и этот факт может ставить под сомнение возможность трансляции результатов таких исследований в реальную клиническую практику. Все это позволяет судить о целесообразности выбора в качестве моделей старых или стареющих животных, возраста 18 месяцев и более.
Для определения параметров эффективности исследуемых препаратов необходимо исследовать биохимический профиль стареющего мозга, изменения биохимических и нейрофизиологических процессов в ответ на патологическое воздействие, оценивать динамику этих изменений.
Изучение проблемы ишемического и реперфузионного повреждения мозга актуально не только для таких патологий, как ишемический инсульт и транзиторная ишемическая атака, но и для ряда нейродегенеративных заболеваний, в патогенезе которых - избыточное накопление АФК в нейронах. К таким нозологиям относятся болезнь Альцгеймера, хорея Гентингтона, боковой амиотрофический склероз [15].
Целью данной работы стало изучение биохимических показателей окислительного стресса, апоптоза и вазодилатации в нейронах головного мозга стареющих крыс в условиях ишемии-реперфузии (ИР) различной длительности.
Ишемия и следующая за ней реперфузия приводит к гибели нейронов двумя основными путями: некроз, как результат окислительного повреждения, и апоптоз - индуцированная через различные механизмы запрограммированная смерть нейронов. Таким образом, оценивать «выживаемость» нейронов следует по различным биомаркерам, характеризующим оба этих процесса.
В соответствии с поставленной целью решались следующие задачи:
1. Исследовать влияние двухсосудистой ишемии-реперфузии головного мозга с гипотензией на накопление продуктов перекисного окисления липидов (ПОЛ) в коре головного мозга стареющих крыс (возраст 22-24 месяцев).
2. Изучить влияние двухсосудистой ишемии-реперфузии головного мозга с гипотензией на уровень экспрессии генов, кодирующих белки апоптоза (Bax, Bcl-2) и ферменты антиоксидантной защиты (Sodl, Sod2, Cat), а также активность фермента Na'.K'-АТФазы.
3. Исследовать особенности вышеперечисленных параметров у старых крыс в сравнении с молодыми в условиях изучаемой ишемии- реперфузии головного мозга.
✅ Заключение
Продление реперфузии приводит к более выраженной активации системы антиоксидантной защиты, чем в случае сходных экспериментов на молодых животных.
Снижение интенсивности большинства процессов, присущее старому мозгу, может рассматриваться и как недостаток, и как преимущество: с одной стороны, ограниченная активность большинства ферментов, в том числе катализирующих окислительно-восстановительные реакции, снижающие уровень АФК и активных форм азота, может способствовать меньшей интенсивности окислительных процессов в нейронах вследствие ишемического повреждения. С другой стороны, сниженные возможности к нейропластичности ограничивают способность мозга восстанавливать функцию после инсульта.