Тема: Влияние экспрессии ядерного рецептора NR4A1 на метастазирование и чувствительность к ДНК-повреждающим препаратам
Закажите новую по вашим требованиям
Представленный материал является образцом учебного исследования, примером структуры и содержания учебного исследования по заявленной теме. Размещён исключительно в информационных и ознакомительных целях.
Workspay.ru оказывает информационные услуги по сбору, обработке и структурированию материалов в соответствии с требованиями заказчика.
Размещение материала не означает публикацию произведения впервые и не предполагает передачу исключительных авторских прав третьим лицам.
Материал не предназначен для дословной сдачи в образовательные организации и требует самостоятельной переработки с соблюдением законодательства Российской Федерации об авторском праве и принципов академической добросовестности.
Авторские права на исходные материалы принадлежат их законным правообладателям. В случае возникновения вопросов, связанных с размещённым материалом, просим направить обращение через форму обратной связи.
📋 Содержание
2. Обзор литературы 6
2.1 Структура и механизм действия рецепторов NR4A 8
2.2 Роль NR4A в процессах клеточной смерти, апоптоза и аутофагии 10
2.3 Роль NR4A иммунной системе, гемопоэтических процессах, воспалении и
аутоиммунных заболеваниях. 11
2.4 Роль NR4A в нервной системе и нейрогенезе 12
2.5 Роль рецепторов NR4A в регуляции метаболизма 12
2.6 Роль представителей подгруппы NR4A в канцерогенезе 14
2.7 Резистентность к химиотерапевтическим препаратам раковых опухолей 16
3. Материалы и методы 20
3.1 Трансформация бактерий и выделение плазмидной ДНК 20
3.2 Получение псевдовирусных частиц и лентивирусная трансдукция 21
3.4 Фенол-хлороформное выделение РНК, проведение обратно-транскриптазной реакции для получения кДНК и анализ экспрессии генов ПНР в реальном времени 23
3.5 Разделение белков в полиакриламидном геле и вестерн-блоттинг 25
3.6 Тетразолиевый тест (МТТ-тест) 28
3.7 Цитофлуометрический анализ клеточного цикла с помощью PI метода
окрашивания ДНК 28
4. Результаты 30
4.1 Подтверждение лентивирусной трансдукции и выполнения нокдауна Nr4a1
клеточных MCF-7 и MDA-MB-231 линий вестерн-блоттингом 30
4.2 Изучение выживаемости клеточных линий с разным статусом экспрессии Nr4a1
при обработке химиотерапевтическими препаратами с помощью МТТ-теста 32
4.3 Определение влияния ядерного рецептора NR4A1 на экспрессию генов,
кодирующих про-апоптотические белки Bax, Bad и Puma после обработки доксорубицином 36
4.4 Определение влияния NR4A1 на уровень белков-регуляторов клеточного цикла
при обработке химиотерапевтическим препаратами 38
4.5 Изучение влияния NR4A1 на экспрессию генов-маркеров эпителиального и
мезенхимального фенотипов с помощью ПЦР в реальном времени 40
4.6 Изучение влияния экспрессии Nr4a1 на клеточный цикл методом проточной
цитометрии с окрашиванием ДНК пропидием йодидом 43
5. Обсуждение 45
6. Выводы 48
Список литературы 49
📖 Введение
Экспрессия генов, кодирующих орфанные ядерные рецепторы, индуцируется в ответ на широкий спектр стимулов. Орфанные ядерные NR4A играют важную роль в регуляции энергетического метаболизма, дифференцировки, пролиферации и роста клеток, нейрогенезе, иммуногенезе, а также участвуют в патогенезе большого количества заболеваний.
Подсемейство ядерных рецепторов NR4A, или NGF-IB-подобных белков, имеет в своем составе 3 представителей: NR4A1, NR4A2, NR4A3. Лиганд-независимая регуляция экспрессии генов, осуществляемая этими белками, имеет сложную природу и зависит от большого количества факторов, включая: белок-белковые взаимодействия, посттрансляционные модификации, в зависимости от клеточного контекста и локализации. Помимо этого, для NR4A1-3 показано наличие нескольких изоформ.
Злокачественная трансформация клеток происходит при нарушении экспрессии генов, регулирующих клеточную смерть, систему репарации ДНК, пролиферацию и рост, взаимодействие с иммунной системой и другими клетками микроокружения. Опухоли разных типов обладают уникальным профилем нарушений экспрессии генов, накапливаемых в ходе патогенеза (Hanahan, Weinberg, 2011).
Участие NR4A1 в онкогенезе прежде всего связано с функциями данного транскрипционного фактора. Нарушения в регулируемых NR4A1 клеточных процессах могут приводить к злокачественной трансформации клеток. Изменения экспрессии Nr4a1 обладают опухоле-специфическим характером, так как функциональная активность ядерного рецептора NR4A1 зависит от клеточного и тканевого контекста. Кроме того, для представителей подсемейства NR4A характерна функциональная избыточность, то есть способность дублировать функции друг друга, что делает сложным исследование индивидуальной роли рецепторов как при нормальных физиологических условиях, так и в ходе патологических процессах.
В последние двадцать лет в противоопухолевой терапии произошел существенный прогресс и было зарегистрировано рекордное количество препаратов нового поколения: селективных лекарств, иммунотерапии, генетической и вирусной терапии. Однако, несмотря на различные ограничения использования препаратов, а также многочисленных побочных эффектов для пациентов, химиотерапия остается эффективным и применяемым терапевтическим подходом. Более того, химиотерапия активно используется в сочетании с лучевой, хирургической, селективной и иммунотерапией. Химиотерапевтические препараты согласно механизму действия можно отнести к ДНК-повреждающим агентам, антиметаболитам, ингибиторам полимеризации микротрубочек и микрофиламентов.
Существенным недостатком химиотерапии является возникновение множественной лекарственной устойчивости. Популяция клеток опухоли из-за высокой частоты мутаций обладает огромной гетерогенностью. В связи с этим связано возникновение широкого спектра механизмов резистентности, включающих: мутацию в белке-мишени, удаление лекарства из клетки, устойчивость к апоптозу, индукция систем репарации ДНК. Несмотря на существенный прогресс в понимании механизмов развития устойчивости к химиопрепаратам, на данный момент развитие резистентности к препаратам является актуальной проблемой для современной медицины.
Белки подсемейства NR4A, являясь важными регуляторами ключевых клеточных процессов, могут участвовать в возникновении устойчивости к химиотерапии. Для NR4A1, как наиболее изученного белка семейства NR4A, на данный момент известны агонисты и антагонисты, что делает NR4A1 наиболее актуальной потенциальной мишенью для фармакологической терапии. Более подробное исследование орфанного ядерного рецептора NR4A1 представляет большой интерес как из-за широкого набора его функций, так и сложной системы белок-белковых взаимодействий.
Целью данного исследования является изучение влияния экспрессии гена, кодирующего ядерный орфанный рецептор NR4A1, на устойчивость к ДНК- повреждающим химиотерапевтическим препаратам, а также на метастатический потенциал клеток.
Для достижения поставленной цели были сформулированы следующие задачи:
1. Осуществить нокдаун гена Nr4a1 в клеточных линиях MCF-7 и MDA-MB- 231 и изучить их выживаемость при обработке ДНК-повреждающими препаратами (доксорубицином, цисплатином или этопозидом).
2. Сравнить уровень экспрессии генов Puma, Bax, Bad, регулирующих апоптоз, в клеточных линиях рака молочной железы с разным статусом экспрессии гена Nr4a1 при обработке ДНК-повреждающими препаратами.
3. Определить влияние NR4A1 на экспрессию генов-маркеров эпителиальномезенхимального перехода - VIM и SNAI1.
4. Изучить влияние экспрессии Nr4a1 на распределение фаз клеточного цикла в популяции клеток линии MCF-7 при воздействии ДНК-повреждающим препаратом этопозидом.
✅ Заключение
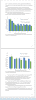
1. Получены стабильные клеточные линии MDA-MB-231 и MCF-7 с нокдауном Nr4a1, показано снижение устойчивости к доксорубицину и цисплатин линии MCF-7 с нокдауном гена Nr4a1 относительно линии, содержащей неспецифическую интерферирующую РНК. Также продемонстрирована резистентность линии MDA-MB-231 с нокдауном к мРНК гена Nr4a1 на воздействие цисплатином и гемцитабином.
2. Выявлено увеличение экспрессии генов, кодирующих про-апоптотические белки Bax, Bad и Puma, в клеточной линии MDA-MB-231 с наличием NR4A1 без обработки доксорубицином. Показано уменьшение относительной экспрессии Bax и Bad в клеточной линии MDA-MB-231 с наличием NR4A1 при обработке 1 и 3 мкМ доксорубицином в течение 24 ч.
3. Продемонстрировано уменьшение экспрессии генов-маркеров эпителиальномезенхимального перехода, SNAI1 и VIM, в клеточной линии MCF-7 с нокдауном Nr4a1.
4. Показано увеличение количества клеток в G0-G1 фазе клеточного цикла в популяции линии MCF-7 с нокдауном Nr4a1 при обработке этопозидом.