Тема: Микро- и наночастицы на основе алифатических сложных полиэфиров для доставки противоопухолевых препаратов
Закажите новую по вашим требованиям
Представленный материал является образцом учебного исследования, примером структуры и содержания учебного исследования по заявленной теме. Размещён исключительно в информационных и ознакомительных целях.
Workspay.ru оказывает информационные услуги по сбору, обработке и структурированию материалов в соответствии с требованиями заказчика.
Размещение материала не означает публикацию произведения впервые и не предполагает передачу исключительных авторских прав третьим лицам.
Материал не предназначен для дословной сдачи в образовательные организации и требует самостоятельной переработки с соблюдением законодательства Российской Федерации об авторском праве и принципов академической добросовестности.
Авторские права на исходные материалы принадлежат их законным правообладателям. В случае возникновения вопросов, связанных с размещённым материалом, просим направить обращение через форму обратной связи.
📋 Содержание
ВВЕДЕНИЕ 5
1. ОБЗОР ЛИТЕРАТУРЫ 8
1.1. Системы доставки лекарств на основе полимерных частиц 8
1.1.1 Типы полимерных частиц 11
1.1.2 Размер и потенциал полимерных частиц 11
1.1.3. Факторы, влияющие на скорость высвобождения лекарств 12
1.2. Биоразлагаемые полимеры для получения микро- и наночастиц 14
1.2.1 Поли(молочная кислота) 16
1.2.2. Синтез поли(молочной кислоты) 17
1.2.3 Свойства ПМК 20
1.2.4. Системы доставки лекарств на основе полимерных частиц из ПМК 21
1.2.5. Поли(в-капролактон) 21
1.2.6. Получение поли(капролактона) 22
1.2.7. Системы доставки лекарств на основе частиц из ПКЛ 23
1.2.8. Поли(этиленгликоль) 24
1.3. Получение полимерных частиц 26
1.3.1. Эмульсионные методы на основе испарения растворителя 27
1.3.1.1. Механизм процесса 28
1.3.1.2. Стабилизация эмульсии 29
1.3.1.3. Ультразвуковая гомогенизация 30
1.3.1.4. Контроль размера микрочастиц 31
1.3.1.5. Влияние концентрации ПАВ на распределение частиц по размерам 31
1.3.1.6. Влияние концентраций полимера и ПАВ 32
1.3.1.7. Влияние молекулярной массы полимера 33
1.3.1.8. Влияние количества лекарственного средства на размер частиц 34
1.3.2. Метод наноосаждения 34
1.3.2.1. Узо-эффект 35
1.3.2.2. Механизм формирования частиц 37
1.3.2.3. Стабилизация наночастиц 38
1.3.2.4. Влияние молекулярной массы полимера на размер частиц 39
1.3.2.5. Влияние концентрации полимера 40
1.3.2.6. Влияние растворителя 41
1.3.2.7. Влияние скорости ввода и перемешивания 42
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ 43
2.1. Материалы 43
2.2. Оборудование 44
2.3. Методы 44
2.3.1. Синтез сополимера ПЭГ-5000-б-ПМК и гомополимера ПМК 45
2.3.2. Синтез сополимера ПЭГ-5000-б-ПКЛ и гомополимера ПКЛ 46
2.3.3. Методы исследования полимеров 46
2.3.4. Получение инкапсулированных наночастиц на основе гомополимеров ПМК, ПКЛ и сополимеров ПЭГ-5000-б-ПМК и ПЭГ-5000-б-ПКЛ методом наноосаждения 47
2.3.5. Получение инкапсулированных микрочастиц на основе гомополимеров ПМК, ПКЛ и сополимеров ПЭГ-5000-б-ПМК и ПЭГ-5000-б-ПКЛ методом одинарной микроэмульсии (масло-в-воде) 48
2.3.6. Количественный анализ инкапсулированного препарата 48
2.3.7. Исследование характеристик полимерных частиц 49
3. ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ 50
3.1. Синтез гомополимера ПМК и блок-сополимера ПЭГ-5000-б-ПМК 50
3.2. Синтез гомополимера ПКЛ и блок-сополимера ПЭГ-5000-б-ПКЛ 55
3.3. Характеристики полимерных частиц 59
3.4. Характеристики инкапсулированных полимерных частиц, полученных методом наноосаждения 66
3.5. Характеристики полимерных микрочастиц 70
3.6. Эффективность инкапсулирования диоксадэта в частицы, полученные методом наноосаждения 77
3.7. Эффективность инкапсулирования диоксадэта в контейнеры, полученные методом одинарной эмульсии 80
ВЫВОДАХ 85
БЛАГОДАРНОСТИ 86
СПИСОК ЛИТЕРАТУРЫ 87
📖 Введение
Действуя в качестве контейнеров для цитостатического препарата, частицы защищают его от преждевременной дезактивации и контакта со здоровыми клетками, а также продлевают период его выведения из организма [2]. Контролируемое и пролонгированное высвобождение лекарства из частиц при оптимальной скорости и режиме дозирования позволяет: увеличивать локальную концентрацию цитостатика в раковых клетках и устранять необходимость в повторном вводе препарата. Контейнеры в условиях осуществления локальной химиотерапии являются источником для непрерывной подачи лекарства в непосредственной близости от патологического очага, что дает возможность увеличивать эффективность терапии и уменьшить побочные эффекты [3].
В настоящее время в качестве систем доставки лекарств, наибольший интерес вызывают частицы на основе биоразлагаемых полимеров, такие как полимерные сферы, мицеллы и полимеросомы. В качестве биоразлагаемых носителей для получения таких частиц наибольшей перспективностью обладают синтетические амфифильные сополимеры алифатических полиэфиров, таких как поли(молочная кислота) или поли(капролактон) с гидрофильными полимерами. Системы доставки лекарств на основе амфифильных сополимеров характеризуются высокой стабильностью в кровяном русле, биосовместимостью с органами и тканями, а также способностью разлагаться с образованием нетоксичных для организма продуктов. Также использование синтетических биоразлагаемых полимеров в качестве основы для частиц позволяет контролировать физико-химические свойства контейнеров, такие как: размер, свойства поверхности и скорость разложения полимерных носителей. Вариация природы полимера и его молекулярномассовых характеристик дает возможность контроля скорости высвобождения лекарственных веществ.
Таким образом, целью данного исследования является: получение микро- и наночастиц на основе амфифильных блок-сополимеров поли(этиленгликоля) с молекулярной массой 5000 (ПЭГ-5000)с поли(молочной кислотой) ПЭГ-5000-б-ПМК и поликапролактоном ПЭГ-5000-б-ПКЛ, способных эффективно инкапсулировать и контролируемо высвобождать противоопухолевые препараты, а также сравнение полученных контейнеров с носителями на основе гомополимеров ПМК и ПКЛ, являющихся широко зарекомендованными себя стандартами в области биомедицины. В рамках данного исследования будет использован новый противоопухолевый препарат из группы алкилирующих соединений этилениминов — диоксадэт.
Достижение поставленной цели определило следующие задачи:
• получение амфифильных блок-сополимеров поли(капролактона) и поли(молочной кислоты) с метиловым эфиром поли(этиленгликоля) и их гомополимеров с различными молекулярными массами;
• анализ состава и молекулярно-массовых характеристик синтезированных полимеров с использованием методов ЯМР-спектроскопии и гель-проникающей хроматографии;
• разработка метода инкапсулирования лекарственного вещества - диоксадэта в полимерные контейнеры на основе алифатических сложных полиэфиров и получение микро- и наночастиц с заданными размерами методами одинарной эмульсии и наноосаждения;
• определение размера и дзета-потенциала полученных частиц с использованием методов динамического рассеяния света и анализа траектории частиц;
• изучение эффективности инкапсулирования и максимальной загрузки противоопухолевого препарата в частицы в зависимости от природы и молекулярной массы полимера, а также метода получения полимерных носителей.
✅ Заключение
1. Исследовано влияние условий полимеризации с раскрытием цикла для получения биосовместимых амфифильных блок-сополимеров на основе поли(этиленгликоля) с молекулярной массой 5000 (ПЭГ-5000)с поли(молочной кислотой) ПЭГ-5000-б-ПМК и поликапролактоном ПЭГ-5000-б-ПКЛ, а также гомополимеров ПМК и ПКЛ на молекулярно-массовых характеристики полимерных носителей.
2. Впервые получены полимерные частицы с инкапсулированным цитостатическим препаратом - диоксадэтом на основе: ПЭГ-5000-б-ПМК, ПЭГ-5000-б-ПКЛ, а также гомополимеры ПМК и ПКЛ. Установлены тенденции формирования полимерных контейнеров, содержащих диоксадэт, полученных с использованием методов: одинарной эмульсии и наноосаждения.
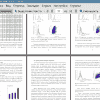
3. Показано, что частицы, полученные методом наноосаждения, содержащие противоопухолевый препарат, имеют диаметр от 90 до 170 нм и характеризуются узким распределением по размерам.
4. Установлено, что контейнеры с цитостатическим препаратом, сформированные методом одинарной эмульсии, содержат частицы мелкой и крупной фракции. Диаметр полимерных контейнеров может варьироваться от 170 до 700 нм.
5. Изучена эффективность инкапсулирования и максимальная загрузка противоопухолевого препарата в полимерные частицы в зависимости от природы и молекулярно-массовых характеристик полимеров, а также от способа получения частиц.
6. Показано, что амфифильные блок-сополимеры ПЭГ-5000-б-ПМК и ПЭГ-5000-б-ПКЛ являются более перспективными носителями по сравнению с гомополимерами на основе ПМК и ПКЛ и характеризуются большими значениями эффективности инкапсулирования и загрузки лекарственного препарата. Максимальная загрузка препарата составляет 108 мкг/мг полимерных частиц, а эффективность инкапсулирования достигает 92 %.