Тема: Водные дисперсии белковых агрегатов: образование и поверхностные свойства
Закажите новую по вашим требованиям
Представленный материал является образцом учебного исследования, примером структуры и содержания учебного исследования по заявленной теме. Размещён исключительно в информационных и ознакомительных целях.
Workspay.ru оказывает информационные услуги по сбору, обработке и структурированию материалов в соответствии с требованиями заказчика.
Размещение материала не означает публикацию произведения впервые и не предполагает передачу исключительных авторских прав третьим лицам.
Материал не предназначен для дословной сдачи в образовательные организации и требует самостоятельной переработки с соблюдением законодательства Российской Федерации об авторском праве и принципов академической добросовестности.
Авторские права на исходные материалы принадлежат их законным правообладателям. В случае возникновения вопросов, связанных с размещённым материалом, просим направить обращение через форму обратной связи.
📋 Содержание
Список условных сокращений 4
Введение 5
1. Обзор литературы 7
1.1. Амилоидные фибриллы 7
1.2. Структура фибрилл 8
1.3. Нативный белок БСА 10
1.3.1. Агрегация БСА 11
1.3.2. Синтез амилоидных фибрилл бычьего сывороточного альбумина 11
1.3.3. Ингибирование фибрилляции 18
1.4. Поверхностные свойства растворов нативного белка БСА 20
1.5. Нативный белок лизоцим куриного белка 22
1.5.1. Поверхностные свойства лизоцима куриного белка 24
1.5.2. Получение и поверхностные свойства амилоидных фибрилл лизоцима 26
2. Экспериментальные методы и методика измерения 28
2.1. Получение амилоидных фибрилл 28
2.1.1. Получение амилоидных фибрилл бычьего сывороточного альбумина 28
2.1.2. Другие методы синтеза амилоидов БСА 29
2.1.3. Получение амилоидных фибрилл лизоцима куриного белка 31
2.2. Очистка дисперсий фибриллярных агрегатов 31
2.2.1. Очистка фибрилл бычьего сывороточного альбумина 32
2.2.2. Очистка фибрилл лизоцима куриного белка 33
2.3. Анализ синтезированных фибрилл 33
2.3.1. Метод атомно-силовой микроскопии 33
2.3.2. Метод гравиметрии 34
2.3.3. Микроскопия при угле Брюстера (БАМ) 34
2.4. Методы поверхностной реологии 35
2.4.1. Определение поверхностного натяжения методом пластинки Вильгельми 37
2.4.2. Определение динамической поверхностной упругости методом осциллирующего барьера 37
3. Результаты и обсуждение 39
3.1. Полученные фибриллярные агрегаты 39
3.2. Результат очистки фибриллярных агрегатов 40
3.3. Адсорбционные пленки амилоидных фибрилл БСА и лизоцима 43
3.4. Нанесенные пленки амилоидных фибрилл БСА и лизоцима 49
3.4.1. Нанесенные пленки БСА и его фибрилл 49
3.4.2. Нанесенные пленки лизоцима куриного белка и его фибрилл 56
Выводы 60
4. Благодарности 61
5. Список литературы 62
📖 Введение
Как упоминалось выше, амилоидные фибриллы распространены в природных системах. Кроме болезнетворных фибрилл, существуют также и функциональные амилоиды [20,21], которые играют роль в специфических процессах жизнедеятельности животных, бактерий и человека. Например, за прочность и эластичность паутины ответственны именно фибриллярные нити, а в меланосомах человека формируются амилоидные фибриллы, на которых плотно упаковывается предшественник меланина, тем самым ускоряя процесс его превращения в меланин [6,21].
Белковые амилоиды крайне полиморфны: их размер, внутренняя структура и форма сильно зависят от условий синтеза. Для результативного изучения методов ингибирования фибрилляции необходимо разработать метод синтеза, позволяющий получать фибриллы, аналогичные таковым из живых организмов.
Нужно отметить, что объемные свойства растворов белков и их агрегатов исследуются часто, и, хотя в подобных системах многие процессы происходят на границах раздела фаз, работ по адсорбции на поверхности таких систем значительно меньше.
Для исследования микро- и наногетерогенных адсорбционных пленок в системах с биомакромлекулами и определения механизма адсорбции в данной работе используется подход, основанный на использовании дилатационной поверхностной реологии в совокупности с оптическими методами, в том числе с различными видами микроскопии.
Основная цель работы заключается в определении механизма формирования адсорбционного слоя амилоидных фибрилл глобулярных белков бычьего сывороточного альбумина (БСА) и лизоцима куриного белка. В частности, предполагается оценить различия структуры и свойств поверхностного слоя фибрилл и нативных глобулярных белков у межфазной границы водный раствор- воздух. Для этих целей, кроме методов дилатационной поверхностной реологии, будут использованы зондовая микроскопия и микроскопия при угле Брюстера.
Поставлены следующие задачи:
1. Синтезировать фибриллы бычьего сывороточного альбумина и лизоцима
2. Найти эффективный доступный способ очистки
3. Рассмотреть влияние внешних условий при проведении синтеза на формирование агрегатов глобулярных белков (БСА и лизоцима) в водных растворах
4. Получить кинетические зависимости поверхностных свойств фибриллярных агрегатов при разных значениях рН и ионной силы
5. На основе полученных данных предложить модель поверхностного слоя растворов фибриллярных агрегатов глобулярных белков.
✅ Заключение
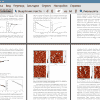
1. Получены фибриллярные агрегаты двух глобулярных белков - бычьего сывороточного альбумина и лизоцима куриного белка. Фибриллы БСА более мягкие и изогнутые, чем фибриллы лизоцима, и имеют меньшую персистентную длину.
2. Подобраны оптимальные условия очистки полученных агрегатов методом центрифугирования. Замедление процесса адсорбции фибрилл после центрифугирования свидетельствует о достаточной степени очистки.
3. Фибриллы БСА и лизоцима образуют устойчивые плотные пленки на поверхности растворов. При сильном уменьшении площади поверхности данные агрегаты не склонны покидать поверхностный слой. Нанесенные пленки фибриллярных агрегатов БСА не разрушаются при сжатии поверхности на % и последующем возвращении к начальной площади, в отличие от пленки фибрилл лизоцима.
4. Ионная сила растворов влияет на адсорбционные и нанесенные пленки фибрилл обоих белков. При нанесении на раствор соли фибриллы способны к более плотной укладке в поверхностном слое из-за уменьшения электростатического барьера адсорбции.