Тема: Исследование коррозии сварных конструкций установки синтеза 4,4-диметил-1,3 -диоксана
Закажите новую по вашим требованиям
Представленный материал является образцом учебного исследования, примером структуры и содержания учебного исследования по заявленной теме. Размещён исключительно в информационных и ознакомительных целях.
Workspay.ru оказывает информационные услуги по сбору, обработке и структурированию материалов в соответствии с требованиями заказчика.
Размещение материала не означает публикацию произведения впервые и не предполагает передачу исключительных авторских прав третьим лицам.
Материал не предназначен для дословной сдачи в образовательные организации и требует самостоятельной переработки с соблюдением законодательства Российской Федерации об авторском праве и принципов академической добросовестности.
Авторские права на исходные материалы принадлежат их законным правообладателям. В случае возникновения вопросов, связанных с размещённым материалом, просим направить обращение через форму обратной связи.
📋 Содержание
1 Аналитический обзор 9
1.1 Химизм производства ДМД 9
1.2 Технологическая схема установки синтеза ДМД 13
1.3 Коррозионная устойчивость стали 10Х17Н13М2Т 19
1.4 Электрохимической поведение стали 10Х17Н13М2Т в кислотах 20
1.5 Электрохимическое поведение железа и нержавеющих сталей в хлорной кислоте 27
1.6 Состояние вопроса и постановка задач исследования 31
2 Методики экспериментов 34
2.1 Реактивы и вспомогательные материалы 34
2.2 Электрохимические исследования границы металл — раствор 35
2.2.1 Экспериментальная установка 35
2.2.2 Потенциодинамические измерения 37
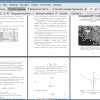
3 Результаты электрохимических исследований и их обсуждение 42
3.1 Коррозия в различных кислотах и их смесях 42
3.2 Испытания ингибиторов коррозии 52
Заключение 68
Список используемых источников 70
📖 Введение
И действительно, как видно на рисунке 1, в течение многолетней эксплуатации на сварных швах возникли сквозные свищи с образованием засохших подтеков.
Актуальность и научная значимость исследования:
Текущий ремонт установки синтеза ДМД представляет значительные технические проблемы и затраты времени. С учетом регулярности возникновения проблемы коррозии швов представляет практический интерес выяснение причин возникновения коррозии и предотвращение коррозии в будущем.
Объект исследования: нержавеющая сталь 10Х17Н13М2Т.
Предмет исследования: процесс коррозии нержавеющей стали 10Х17Н13М2Т в различных агрессивных средах.
Цель исследования: выявление условий предотвращения коррозии узлов установки синтеза ДМД.
Гипотезы исследования: основные проблемы, которые могут возникнуть при решении задачи предотвращения или значительного замедления коррозии стали 10Х17Н13М2Т в условиях работы установки синтеза ДМД:
Рисунок 1 - Состояние некоторых узлов установки синтеза ДМД
• Поверхность стали, особенно у сварных швов, неоднородна по химическому составу и физическому состоянию. Это в обязательном порядке обуславливает электрохимическую коррозию стали. При этом наиболее активные участки поверхности работают в анодном режиме (растворение стали), а на других локализуется катодный процесс восстановления деполяризатора. Поверхность стали покрыта пленкой в основном из соединений железа, хрома и молибдена.
• Растворение стали на анодных участках происходит путем диффузии ионов железа в пленке от металла в раствор. Деполяризатор (ионы ClO4-) на катодных участках диффундируют через пленку в обратном направлении и восстанавливаются между пленкой и металлом до хлорид-ионов. В свою очередь, хлорид-ионы образуют легко растворимые соединения железа, что резко усиливает коррозию железа.
Образование агрессивных хлорид-ионов в процессе катодной деполяризации сталей отличает коррозию в хлорной кислоте от коррозии в других кислотах, где происходит водородная деполяризация. Поэтому среда хлорной кислоты делает защиту нержавеющих сталей от коррозии трудновыполнимой. Хлорид-ионы накапливаются в труднодоступных местах, например, под прокладками между фланцами, в раковинах на внутренней поверхности сварных швов, вследствие чего наблюдается повышенная коррозия в таких местах. Это приводит к изъязвлению фланцев (щелевая коррозия) и усиленной коррозии в раковинах сварных швов.
• На поверхности стали 10Х17Н13М2Т в фосфорной кислоте образуются защитные пленки. Поэтому есть смысл проверить скорость коррозии стали в этой кислоте в условиях работы установки.
• Возможно, в смеси хлорной и фосфорной кислот коррозия стали 10Х17Н13М2Т будет протекать с меньшей скоростью, чем в хлорной. Необходимо проверить это предположение.
• Коррозия стали 10Х17Н13М2Т протекает как по всей поверхности, так и, в основном, по питтинговому механизму. Универсальным методом снижения коррозии по всем механизмам является использование ингибиторов коррозии.
Необходимо подобрать ингибитор, не влияющий на технологические параметры процесса в установке. Ингибитор должен быть химически стабильным при 90 - 100°С, оказывать максимальную эффективность при минимальной концентрации и быть растворимым в органической фазе установки.
• После подбора ингибитора коррозии целесообразно проверить его действие на реальной водной фазе установки синтеза ДМД.
Для достижения поставленной цели необходимо решить следующие задачи:
• Определить скорость коррозии стали 10Х17Н13М2Т в 1% хлорной кислоте при 90°С;
• Определить скорость коррозии стали 10Х17Н13М2Т в 1% фосфорной кислоте при 90°С;
• Определить скорость коррозии стали 10Х17Н13М2Т в смеси 1% хлорной кислоты и 0,5% фосфорной кислоты при 90°С;
• Подобрать эффективный ингибитор коррозии стали 10Х17Н13М2Т хлорной кислоте при 90°С;
• Определить скорость коррозии стали 10Х17Н13М2Т в реальной водной фазе установки синтеза ДМД без ингибитора коррозии и с ним.
Теоретико-методологическую основу исследования составили:
Научная литература по исследованию коррозии нержавеющих сталей, а также учебные пособия по теории и методам исследования коррозии металлов.
Методы исследования:
Аналитический обзор научной литературы, экспериментальный потенциодинамический метод исследования коррозии металлов.
Научная новизна исследования:
- Впервые исследована скорость коррозии стали 10Х17Н13М2Т в хлорной кислоте;
- Впервые исследована скорость коррозии стали 10Х17Н13М2Т в смеси фосфорной и хлорной кислот;
- Впервые определена скорость коррозии стали 10Х17Н13М2Т в реальной водной фазе установки синтеза ДМД.
Теоретическая значимость исследования:
Результаты исследования представляют теоретический интерес с точки зрения объяснения результатов потенциодинамических исследований.
Практическая значимость исследования:
Результаты исследования позволили выдать практические рекомендации по предотвращению коррозии узлов установки синтеза ДМД.
Достоверность и обоснованность результатов исследования обеспечивались точным соблюдением методик и инструкций при проведении эксперимента, использованием современных методов обработки результатов экспериментов.
Личное участие автора в организации и проведении исследования состоит в аналитическом поиске научной литературы, участии в проведении экспериментального исследования, обработке и обобщения полученных результатов.
На защиту выносятся результаты исследования:
1. Скорости коррозии стали 10Х17Н13М2Т в 1% хлорной кислоте при 90°С;
2. Скорости коррозии стали 10Х17Н13М2Т в 1% фосфорной кислоте при 90°С;
3. Скорости коррозии стали 10Х17Н13М2Т в 1% фосфорной кислоте при 90°С;
4. Скорости коррозии стали 10Х17Н13М2Т в смеси 1% хлорной кислоты и 0,5% фосфорной кислоты при 90°С;
5. Подбора эффективного ингибитора коррозии стали 10Х17Н13М2Т хлорной кислоте при 90°С.
6. Скорости коррозии стали 10Х17Н13М2Т в реальной водной фазе установки синтеза ДМД без ингибиторов коррозии и с ними при 90°С.
Структура магистерской диссертации.
Работа состоит из введения, трех частей, заключения, содержит 32 рисунка, 3 таблицы, список использованной литературы (31 источник). Основной текст работы изложен на 73 страницах.
Во введении обосновываются актуальность темы исследования, определяются объект, предмет, цель, ведущая идея, выдвигается гипотеза и формулируются задачи работы, характеризуются научная новизна, теоретическая и практическая значимость результатов исследования.
✅ Заключение
2. Исследована электрохимическая коррозия стали в реальной водной фазе установки синтеза ДМД при 90°С. Скорость коррозии имеет величину 1...3 мкм/год.
3. Исследована коррозия стали в 1М хлорной кислоте в присутствии ингибитора коррозии бензотриазола и без него при 90°С. и различной концентрации бензотриазола. Эффективность ингибирования при концентрации бензотриазола 1*10-3 моль/л составляет (33±10)%, а при концентрации 1x10-4 - (36±13)%, т.е. достигает 50%.
4. Исследована коррозия стали в 1% хлорной кислоте в присутствии бензотриазола и без него при 90°С. Скорость коррозии без ингибитора составляет 9,5 мкм/год, а с ингибитором - 3,8±1,1 мкм/год. Следовательно, эффективность ингибирования бензотриазола в 1% хлорной кислоте составляет (54±18)%, т.е. достигает 70%. Эффект ингибирования проявляется не только при потенциалах, близких к стационарному, но при всех анодных потенциалах.
5. Исследована электрохимическая коррозия стали в реальной водной фазе установки синтеза ДМД с добавками ингибиторов 1x10-3 моль/л бензотриазола и меркаптобензотриазола при 90оС. Величина скорости стационарной коррозии для всех растворов составляет 1...3 мкм/год. Показано, что оба ингибитора практически не замедляют скорость коррозии.
6. Высказано предположение, что сравнительно невысокая скорость коррозии стали в водной фазе установки обусловлена адсорбцией на поверхности стали молекул формальдегида. Т.е. в водной фазе формальдегид при концентрации 5...10% является более успешным ингибитором коррозии, чем исследованные ингибиторы при их концентрации 1*10-3 моль/л.
7. На поляризационных кривых при достаточно высоких потенциалах в водной фазе область пассивности отсутствует. Эффект исследованных ингибиторов проявляется только при высоких анодных потенциалах.
8. Общая скорость коррозии образцов стали со сварным швом практически не отличается от скорости коррозии образцов без шва. При коррозии сварных конструкций в жидких средах основными видами коррозии являются питтинговая и щелевая. Отличить эти виды коррозии от фронтальной коррозии при электрохимических методах исследования крайне затруднительно, т.к. полученные величины скорости коррозии характеризуют общую скорость коррозии без выделения из нее скорости питтинговой.
9. Наличие свищей на сварных швах обусловлено в основном не коррозией стали, а неудовлетворительным качеством сварки. Внутренняя поверхность швов, по-видимому, имеет большое количество дефектов, которые со временем преимущественно разъедаются за счет питтинговой коррозии вплоть до появления свищей.
На основании приведенных выше выводов можно дать следующие основные рекомендации:
1. Для замедления коррозии стали и сварных швов все же можно рекомендовать введение в водную фазу исследованных ингибиторов коррозии в количестве 1*10-3 моль/л. Это позволит продублировать защитное действие формальдегида, если его концентрация в водной фазе по технологическим причинам опустится ниже 2%.
2. Для повышения коррозионной стойкости сварных соединений необходимо повысить культуру производства, соблюдать требования нормативных документов по сварке. Процессы сварки необходимо вести с минимальным тепловложением.